La myéloencéphalopathie à EHV1 : encore beaucoup de choses inexpliquées… – bulletin n°15
Xavier D’ABLON (1)
 La rhinopneumonie forme nerveuse est une maladie toujours d’actualité dans le monde entier (des cas récents sont décrits au Canada et au Royaume Uni). Il s’agit d’une manifestation relativement rare d’infection herpétique (due à EHV1, rares cas dus à EHV4) qui peut constituer une véritable catastrophe économique, par les pertes et la lourdeur des soins vétérinaires qu’elle peut engendrer. C’est une myéloencéphalopathie diffuse et multifocale qui fait suite à une vasculite, une thrombose, une hémorragie, et une ischémie des tissus nerveux.
La rhinopneumonie forme nerveuse est une maladie toujours d’actualité dans le monde entier (des cas récents sont décrits au Canada et au Royaume Uni). Il s’agit d’une manifestation relativement rare d’infection herpétique (due à EHV1, rares cas dus à EHV4) qui peut constituer une véritable catastrophe économique, par les pertes et la lourdeur des soins vétérinaires qu’elle peut engendrer. C’est une myéloencéphalopathie diffuse et multifocale qui fait suite à une vasculite, une thrombose, une hémorragie, et une ischémie des tissus nerveux.
Des caractéristiques épidémiologiques très variables :
L’herpes virus équin a une distribution mondiale. Par rapport à l’étendue de ce virus ubiquitaire, les épisodes de formes nerveuses restent relativement rares.
– L’encéphalomyélopathie à EHV1 peut se produire en toute période de l’année (plus volontiers en fin d’hiver, printemps, début d’été).
– Elle peut se produire même en l’absence d’avortement ou d’infection respiratoire constatée.
– Elle peut se produire dans des populations fermées, sans l’introduction de nouveaux chevaux : la réactivation d’une infection latente est un phénomène important dans l’épidémiologie des infections à EHV1.
– Elle touche en général de multiples individus sur une période de quelques semaines, sur un ou plusieurs lieux dans une zone géographique limitée, mais peut aussi être sporadique et individuelle.
– La morbidité est très variable : de 1% à 90%.
– La mortalité l’est tout autant : de 0,5% à 40%.
Que connaissons-nous de la pathogenèse ?
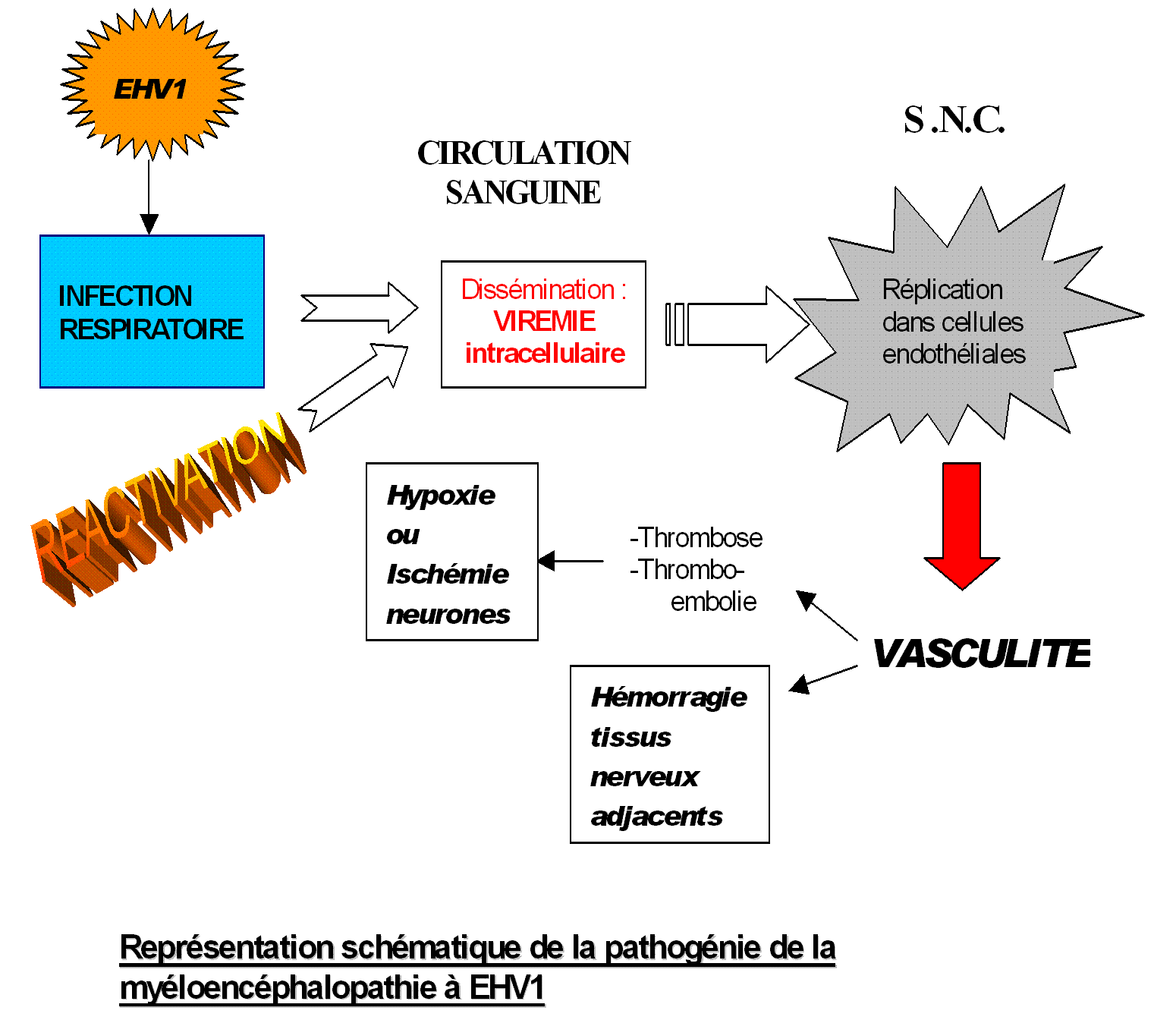
Il n’y a pas d’invasion neuronale par le virus, ni de multiplication dans les tissus nerveux. L’herpes virus équin n’est pas neurotrope, mais endothéliotrope.
Après contamination respiratoire, le virus est phagocyté, passe dans la circulation où il est transporté au sein des monocytes ou des lymphocytes T. C’est la phase de virémie et de dissémination, jusqu’aux cellules endothéliales de certains organes, comme le SNC. Au niveau de l’endothélium des artérioles, il y a une réplication virale qui se manifeste par une vasculite et des phénomènes de thrombose qui provoquent une ischémie des neurones et des hémorragies.
Quand on a identifié ces lésions à l’histologie, on a invoqué un phénomène d’Arthus (hypersensibilité de type III), d’autant que parallèlement on avait constaté que l’infection touchait plus volontiers et plus sévèrement des chevaux qui avaient préalablement des taux élevés d’anticorps. En fait, on n’a pas constaté de vasculite dans les zones où le virus ne s’est pas répliqué, et l’on n’a pas retrouvé non plus d’immuncomplexes dans les reins. De plus, il semblerait que les lésions histologiques soient plus précoces que le pic d’immuncomplexe.
Il reste donc des zones d’ombre dans la connaissance de la pathogenèse à médiation immune.
Les facteurs de risque ?
Dans quels cas des formes nerveuses vont-elles se développer après un épisode respiratoire classique ?
Pourquoi certains chevaux seront-ils atteints et pas d’autres ? Qu’est-ce qui décide de la sévérité de l’atteinte nerveuse ?
Existe-t-il un facteur « X » qui induit une atteinte nerveuse lors d’un épisode herpétique, ou s’agit-il uniquement d’une question de charge virale ?
On ne dispose que de quelques éléments de réponse…
– Lors d’une malade expérimentale, en administrant la même souche de virus, à la même dose, on obtient un nombre variable d’atteintes nerveuses. Le rôle de l’immunité individuelle est certainement très important.
– Si l’on effectue, lors d’un épisode naturel, des PCR quantitatives (quantification de la virémie) sur les chevaux fébriles sans signe nerveux et sur les chevaux atteints de forme nerveuse, on ne trouve pas de différence… La charge virémique ne serait donc pas essentielle.
– Une étude épidémiologique a été faite sur 9 épisodes de myéloencéphalopathie à EHV1 aux Pays Bas. Le seul facteur de risque identifié par les analyses statistiques était la fièvre… On a remarqué que certaines races étaient plus atteintes (Standardbred, Pur sang, Selle), contrairement aux chevaux lourds et aux poneys, même si ces derniers étaient sur le même site et avaient une hyperthermie. Quant aux chevaux Frisons, jamais aucun cas de forme nerveuse n’a été constaté, alors qu’il existe la forme abortive dans cette race.
En conclusion, il reste beaucoup de choses à expliquer :
– La dose infectieuse en elle-même n’explique pas le nombre de chevaux atteints ou la variation des signes nerveux.
– La virémie est une caractéristique commune des infections à EHV1, mais ne conduit pas forcément à des complications nerveuses
– On ne sait pas s’il existe un « seuil critique » de charge virale.
L’ACICLOVIR : le traitement de choix ?
Il n’existe pour l’instant que 2 études sur ce traitement dont les bénéfices ne sont pas clairement définis.
– Il est efficace contre la réplication de EHV1 in vitro
– Il est efficace contre EHV1 in vivo dans un modèle animal (à 100mg/Kg chez le hamster)
Lors des récentes épizooties dans différentes universités américaines, des études supplémentaires ont pu être effectuées :
– une étude de pharmacocinétique : des concentrations plasmatiques raisonnables ont été atteintes
– une étude de sensibilité : tous les virus isolés se sont révélés sensibles
– aucun problème de tolérance n’a été identifié.
En suivant le protocole ci-après, lors d’une épizootie au sein de l’Université de Findlay, il n’y a eu aucun cheval mort.
Certains chevaux ont développé une forme nerveuse après que le traitement ait été commencé, mais aucun n’a montré des troubles nerveux supérieurs à un degré 3 sur une échelle de 5.
Le protocole habituellement recommandé est le suivant :
10mg/Kg, 5 fois/jour P.O.
Ou bien : 10 mg/Kg, 3 fois/jour I.V.
Le prix du traitement est abordable rapporté au risque de mortalité et au coût de traitement d’un cheval sévèrement atteint : environ 75 euros /jour en comprimés (beaucoup plus cher par voie I.V.).
Des études sont encore nécessaires pour déterminer avec précision la dose et le rythme d’administration.
L’élimination de l’aciclovir se faisant par voie rénale, une surveillance est conseillée si on prolonge le traitement.
Vaccination et forme nerveuse d’EHV1 :
La vaccination contre les herpes virus équin fait toujours l’objet de controverses, en raison du portage latent et de la localisation intracellulaire du virus qui compliquent beaucoup la mise au point de vaccins efficaces.
Quel que soit le type d’affection (respiratoire, abortive ou nerveuse) la vaccination ne bloque pas l’infection, ni l’induction de la virémie et du portage latent. Cependant, elle diminue l’excrétion virale chez les chevaux infectés. A ce titre, la vaccination participe indirectement à la prévention de la myéloencéphalopathie à EHV1.
Si la vaccination apporte une certaine protection contre les infections respiratoires et réduit l’incidence des avortements, elle ne prévient pas la forme nerveuse de l’infection à EHV1.
A l’époque où l’on invoquait en priorité le phénomène d’Arthus (immuns complexes) dans la pathogenèse, la vaccination était même reconnue comme un facteur de risque de la forme nerveuse (k du taux d’anticorps circulants).
Lors du grave épisode de l’Université de Findlay (à savoir 130 chevaux touchés, 12 morts), de même que dans les autres lieux qui ont connus de telles crises à cette époque aux E.U., tous les chevaux malades étaient régulièrement vaccinés, à tel point que l’on s’est posé la question de savoir si un variant de EHV ne circulait pas. Mais l’ADN des virus isolés n’était pas différent de virus plus anciens.
Une importante étude (non encore publiée) est conduite actuellement au Kentucky et à Newmarket sur les caractéristiques génétiques des différentes souches de EHV1 isolées lors d’épisodes abortifs ou nerveux dans les 40 dernières années en Amérique du Nord et en Europe.
Une mutation génétique a été découverte sur les souches responsables de formes nerveuses. C’est cette mutation qui expliquerait la pathophysiologie particulière de la myéloencéphalopathie à EHV1 : la virémie et la réplication importante du virus, le tropisme pour le système nerveux, et la relative inefficacité des vaccins à protéger de cette maladie. Cette mutation se produit-elle de novo au début d’un épisode ou bien existe-t-il une sous-population de chevaux porteurs latents de ces virus mutants ?
Les résultats de cette étude seront très intéressants pour la prévention et le contrôle de cette maladie.
Au final, que sait-on ?
1- La vaccination ne protège pas contre la maladie nerveuse
2- On ne doit pas vacciner « dans l’œil du cyclone »
La vaccination reste conseillée pour limiter la circulation du virus. Elle doit commencer tôt (dés l’âge de 3-4 mois), car on pense que le portage latent peut se développer très précocement, et être poursuivie à un rythme soutenu, en fonction du contexte épidémiologique.
De nouveaux types de vaccins sont à l’étude, en particulier un vaccin intranasal, qui viseront la cytotoxicité plus que la protection humorale, et qui seront les bienvenus pour lutter contre ce virus aux caractéristiques particulières.
Sources :
Congrès ACVIM 2004
Congrès BEVA 2004
M. Levy (EPU Alfort 2004)
Equine Internal Medecine 2nd ed. 2004
Pour en savoir plus :
C. Moussu
(PVE 2002 34 (136), 9-15)
(1) Clinique vétérinaire de la Côte Fleurie

