La rhinopneumonie : nouveau regard sur la maladie – bulletin n°40
Introduction
La rhinopneumonie demeure le nom usuel pour caractériser les infections à herpèsvirus équin 1 et 4 (HVE-1 et HVE-4). C’est également le nom référencé par l’OIE pour les recommandations ayant trait à ses infections. Néanmoins, les travaux de recherche de ces 10 dernières années ont contribué à apporter de la connaissance sur la maladie : meilleure connaissance des pathogènes, meilleure connaissance de la physiopathologie ; meilleure efficacité des outils de détection et de caractérisation. Les infections à HVE-1 et HVE-4 présentent néanmoins des différences souvent méconnues.
Cette synthèse non-exhaustive a pour but de partager des informations théoriques et surtout pratiques pouvant faciliter le quotidien du praticien face à des cas d’infection à herpèsvirus dans les élevages équins.
La rhinopneumonie : vue par les virologues
Depuis la dénomination de cette pathologie attribuée à l’HVE-1 puis aux HVE 1 et 4 depuis la découverte de l’HVE-4 (Studdert et al. ; 1981) d’autres herpèsvirus équins ont été découverts dont certains associés à des formes respiratoires plus bénignes (HVE-2 et HVE-5). L’HVE-3, responsable de l’exanthème coïtal, semble quant à lui cantonné à la sphère génitale.
D’autres herpèsvirus retrouvés chez les équidés comme l’HVE-9 chez le zèbre présentent une forte homologie avec l’HVE-1 (figure 1). L’HVE-9 est plus proche phylogénétiquement de l’HVE-1 que ne l’est l’HVE-4. L’HVE-9 a entrainé des formes nerveuses de la maladie non décrites à ce jour avec l’HVE-4.
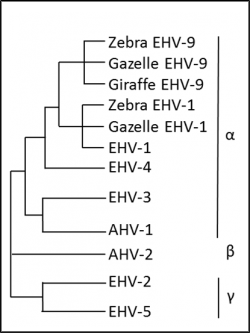
Figure 1 : Arbre phylogénétique des herpèsvirus chez les équidés
(HVE noté EHV pour Equine HerpesVirus).
Les travaux sur l’HVE-4 ne représentent qu’une infime partie des publications référencées sur les herpèsvirus équins. Pourtant, depuis la publication de Davison en 2010, l’HVE-4 est nommé virus de la rhinopneumonie. L’HVE-1 est quant à lui nommé virus abortif. Ces nouvelles dénominations font suite aux publications qui ont démontré que l’HVE-1 était la première cause virale d’avortement infectieux chez la jument, les cas d’avortement à HVE-4 étant extrêmement rares. A contrario, l’HVE-4 est souvent le virus incriminé dans les formes respiratoires de la maladie, même si la présence de l’HVE-1 est loin d’être négligeable.
Ces observations sont illustrées par les données du RESPE (tableau 1) qui corroborent le bienfondé de ces nouvelles dénominations. On peut néanmoins souligner que ces appellations ne prennent pas en compte la forme neurologique de la maladie décrite sous l’appellation myéloencéphalopathie à HVE-1.
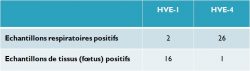
Tableau 1 : Résultats des échantillons PCR détectés dans les liquides respiratoires
et les tissus issus d’avortement à LABÉO en 2013.
Si les virus présentent une forte homologie au niveau génétique, l’avancée des connaissances a montré que des différences importantes existaient qui pouvaient expliquer l’implication d’un virus plutôt que d’un autre dans les différentes formes de la maladie (respiratoire, abortive et neurologique).
Le tropisme cellulaire des deux virus est différent. Ainsi, si les deux virus HVE-1 et HVE-4 présentent un tropisme pour les cellules épithéliales de la trachée et les PBMC (cellules mononucléées du sang périphérique), il semble que seul HVE-1 puisse infecter les cellules endothéliales (figure 2). Ceci pourrait expliquer les très rares cas d’avortement induits par HVE-4 qui pourraient être dus à des souches particulières d’HVE-4. A ce jour, peu d’informations sont publiées sur le rôle d’HVE-4 dans la forme nerveuse de la maladie.
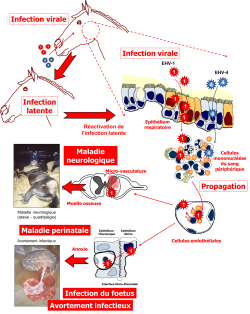
Figure 2 : Schéma illustrant la différence de tropisme cellulaire de l’HVE-1 (virus rouge)
et l’HVE-4 (virus bleu).
Pourquoi l’échange entre le praticien et son laboratoire est essentiel ?
Face à un cas d’infection à HVE-1 et 4 avec des signes cliniques évocateurs, quel qu’il soit, le diagnostic de certitude ne peut être obtenu qu’après la mise en évidence du virus (Lunn et al. ; 2010). L’histologie et l’observation de lésions caractéristiques sont nécessaires dans les cas de myéloencéphalopathie.
Si les outils de diagnostic par PCR que nous avons développés ces 20 dernières années ont été optimisés pour gagner en sensibilité, en temps et permettent aujourd’hui de quantifier la charge virale présente dans l’échantillon, l’interprétation du résultat demeure soumise à une bonne maitrise des procédés, des informations sur l’échantillon, sur l’animal affecté et une parfaite connaissance de la physiopathologie de la maladie.
L’objet de ce chapitre est d’illustrer à partir d’un schéma issu d’une publication décrivant une infection expérimentale (Goerhing et al. ; 2008) différents cas de figure auxquels peut être confronté le praticien sur le terrain et d’aider à une analyse simple et concrète en fonction 1/ des données du laboratoire et 2/des informations que possède le praticien qui a réalisé le prélèvement.
Aide à la lecture :
L’objet de cet encadré est de donner les clés de lecture des graphes ci-dessous. La courbe rouge représente le suivi de la température à partir du jour de l’infection (J0). La courbe bleue représente le suivi de la charge virale dans l’écouvillon nasal. Les histogrammes orange représentent le suivi de la charge virale dans l’échantillon sanguin. Les premiers signes cliniques respiratoires sont apparus 48h post-infection et les premiers signes d’atteinte neurologique 8 jours post-infection.
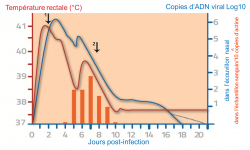
Figure 3 : Infection expérimentale à HVE-1. Suivi de la température rectale et de la charge virale présente dans les écouvillons nasaux et le sang. 1 : apparition des premiers signes respiratoires. 2 : apparition des premiers signes neurologiques (d’après Goerhing et al. 2008).
La figure 3 illustre l’intérêt du prélèvement nasal dans la détection d’HVE-1 suite à une infection virale. Ce schéma permet également de comprendre les différences de résultat pouvant être observées sur le terrain en fonction du type de prélèvement (écouvillon nasal et sang) et du moment où ces prélèvements sont réalisés.
Les figures 4, 5 et 6 illustrent différentes situations pouvant être rencontrés sur le terrain et démontrent l’importance des échanges entre le praticien et son laboratoire expert pour une aide à l’interprétation des résultats.
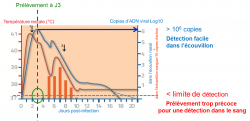
Figure 4 : Cas où le praticien arrive le jour suivant les premiers signes respiratoires (J3). La température est toujours élevée. La charge virale dans l’écouvillon nasal est maximale et facile à détecter. Le prélèvement est trop précoce pour détecter le virus dans le sang. 1 : apparition des premiers signes respiratoires. 2 : apparition des premiers signes neurologiques (d’après Goerhing et al. 2008).
La figure 4 illustre l’importance de réaliser un prélèvement sur écouvillon nasal pour mettre en évidence le virus par PCR. L’absence de virus dans le sang ne traduit pas dans ce cas une absence d’infection. On mesure ainsi le risque d’interprétation d’un résultat sur un prélèvement de sang uniquement, face à des signes cliniques évocateurs.

Figure 5 : Cas où le praticien réalise un prélèvement 4 jours après l’apparition des premiers signes cliniques neurologiques. La charge virale dans l’écouvillon nasal est minimale et nécessite de s’adresser à un laboratoire qui réalise un test PCR très performant. Le prélèvement est trop tardif pour détecter le virus dans le sang. 1 : apparition des premiers signes respiratoires. 2 : apparition des premiers signes neurologiques (d’après Goerhing et al. 2008).
Ce cas de figure illustre l’importance d’avoir les informations sur le moment où le prélèvement est réalisé suite à l’apparition des signes cliniques. Si le propriétaire tarde à appeler son vétérinaire, les chances de détecter le virus s’amenuisent au fil du temps. Dans tous les cas, l’écouvillon nasal reste le prélèvement de choix et le test PCR devra être performant pour une bonne détection d’une charge virale qui diminue avec le temps. On peut estimer que 8 jours après les premiers signes cliniques évocateurs d’une forme nerveuse, les chances de détecter le virus sont faibles. Ceci n’est cependant pas une règle et notre expérience a montré que l’on pouvait détecter de l’HVE-1 jusqu’ à 35 jours post infection.
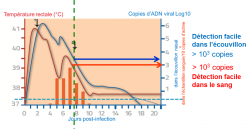
Figure 6 : Le cas idéal face à un cas de myéloencéphalopathie : Le praticien est appelé le jour des premiers signes cliniques neurologiques et réalise les prélèvements. La charge virale dans l’écouvillon nasal et dans le sang demeure assez élevée et permet la mise en évidence du virus dans les deux compartiments biologiques. 1 : apparition des premiers signes respiratoires. 2 : apparition des premiers signes neurologiques (d’après Goerhing et al. 2008).
La figure 6 illustre le cas idéal face à un cas de myéloencéphalopathie. Les prélèvements de sang et sur écouvillon nasal sont réalisés le jour de l’apparition des signes cliniques. La charge viral dans les échantillons, si elle n’est plus maximale, ne posera aucun problème de sensibilité et pourra dans tous les cas être détectée par un laboratoire expert.
Nous préciserons ici que si le prélèvement de liquide céphalo-rachidien n’est pas évoqué sur ces schémas, il représente un prélèvement de choix dans les formes nerveuses de la maladie. Il est néanmoins admis (Conférence de Consensus 2009, Lunn et al.) qu’un résultat PCR négatif sur ce type de prélèvement n’exclut pas la possibilité de la présence du virus. En effet, ce type d’échantillon est plus difficile à analyser par les tests PCR en particulier à cause de la paucicellularité.
Dans tous les cas un résultat positif, sur un prélèvement réalisé dans les règles de l’art (éviter la contamination sanguine qui peut être source de génome HVE) sera très informatif. La charge virale rencontrée est en général relativement faible.
Concernant la détection suite à un avortement, il est recommandé d’adresser les organes du fœtus (foie + poumon + rein) et le placenta (Léon et al.2008). La détection d’HVE-1 par PCR est associée dans plus de 80% des cas à une charge virale très importante. Des mesures sanitaires doivent être prises pour éviter tout risque de contamination.
Les infections à herpèsvirus ont marqué les esprits ces dernières années. Des épizooties à HVE-1 et HVE-4 en France sont encore dans toutes les mémoires. Si la vaccination demeure un des moyens de prévention les plus efficace, face à l’apparition des signes cliniques un diagnostic rapide doit être posé pour prendre et maintenir ou non les mesures contraignantes qui s’imposent. Qu’il s’agisse de l’HVE-1 ou de l’HVE-4, des tests PCR ont été développés qui ont montré leur efficacité. Il est important cependant de rappeler que tout test présente des limites (limite de sensibilité, limite de spécificité) et surtout que quel que soit le test utilisé, il est essentiel d’avoir des informations sur l’échantillon pour une bonne interprétation des résultats.
Pour en savoir plus :
Davison AJ. Herpesvirus systematics. Vet Microbiol. 2010 Jun 16;143(1):52-69. 2010 Feb 11.
Goehring LS, van Maanen C, Berendsen M, Cullinane A, de Groot RJ, Rottier PJ, Wesselingh JJ, Sloet van Oldruitenborgh-Oosterbaan MM. Experimental infection with neuropathogenic equid herpesvirus type 1 (EHV-1) in adult horses. Vet J. 2010 Nov;186(2).
Léon A, Fortier G, Fortier C, Freymuth F, Tapprest J , Leclercq R, Pronost S. Detection of equine herpesviruses in aborted fetuses by consensus PCR. Vet Microbiol 2008 126(1-3): 20-9.
Lunn DP, Davis-Poynter N, Flaminio MJ, Horohov DW, Osterrieder K, Pusterla N, Townsend HG. J Vet Intern Med. 2009 May-Jun;23(3):450-61.
Studdert, M.J., Simpson, T., Roizman, B., 1981. Differentiation of respiratory and abortigenic isolates of equine herpesvirus 1 by restriction endonucleases. Science 214, 562–564.
Take Home message :
– La rhinopneumonie demeure le nom usuel pour caractériser les infections à herpèsvirus équin 1 et 4 (HVE-1 et HVE-4). HVE-1 est le virus abortif et HVE-4 le virus de la rhinopneumonie.
– Les échantillons à prélever en cas de suspicion d’un cas de forme neurologique sont :
o Un écouvillon naso-pharyngé pour PCR HVE-1 : à privilégier dans tous les cas ;
o Un échantillon de sang EDTA pour PCR HVE-1 ;
o Un prélèvement de LCR sur tube EDTA pour PCR HVE-1 si réalisable. Un résultat négatif n’exclut pas la présence du virus (difficulté d’interprétation liée au prélèvement).
(1) LABÉO, Caen, France.
(2) BIOTARGEN EA7450 Normandie Univ, UNICAEN, Caen , France.
(3) RESPE, 3 rue Nelson Mandela 14280 Saint Contest.
(4) Chaire d’excellence Immunologie Equine, U2RM EA 4655, Normandie Univ, UNICAEN, Caen, France
(5) Animal Health Trust (AHT), Lanwades Park, Kentford Newmarket, CB87UU, Royaume-Uni
(6) Clinique .vétérinaire FR-VET, 19 rue de Créhange 57380 Faulquemont, France
(7) Commission maladies infectieuses AVEF, 34 rue Bréguet 75 011 Paris

