Sous réseau « SRA » : Bilan 2009 et perspectives – bulletin n° 27
Xavier D’ABLON (1), Guillaume FORTIER (2) et Pierre-Hugues PITEL (2)
Les nouveautés 2010
Rhinopneumonie : identification d’HVE1 et HVE4 par PCR :
L’expérience des années passées, confortée par un consensus scientifique solide, amène aux remarques suivantes concernant l’utilisation de la cinétique de sérologie pour le diagnostic de la rhinopneumonie :
– il s’agit d’une méthode dont les résultats sont trop longs pour apporter une aide efficace dans la gestion d’un foyer d’infections respiratoires aigues puisqu’il faut 12 à 15 jours entre les deux sérologies
– l’interprétation en est souvent délicate, en particulier sur des chevaux vaccinés
– sa sensibilité semble parfois insuffisante, en particulier s’il s’agit de réactivation d’une infection latente. Par ailleurs elle ne permet pas de faire la distinction entre les différents HVE.
– en pratique la cinétique est trop souvent abandonnée par les vétérinaires sentinelles : la deuxième prise de sang à 15 jours n’est pas effectuée.
La résultante de ces éléments est que le nombre de foyers de rhinopneumonie forme respiratoire identifié par cette méthode dans le cadre du RESPE est très faible (2 foyers en 2009, 4 foyers en 2008). Le collège « SRA » du RESPE a donc proposé au CST d’abandonner cette méthode diagnostique au profit de la PCR.
L’utilisation de la PCR pour l’identification de HVE1 et HVE4 (voir article dans ce bulletin) présente les avantages suivants :
– Rapidité
– Simplicité (même écouvillon que pour la Grippe)
– Méthode sensible et spécifique (HVE1/HVE4)
– Possibilité de faire appel à cette technique lors de suspicion de foyer de forme abortive (formes respiratoires concomitantes) ou lors de rhinopneumonie forme nerveuse (chevaux en contact, chevaux hyperthermiques) afin de confirmer rapidement le diagnostic
En raison de la forte sensibilité de cette méthode, les résultats doivent être interprétés en fonction des éléments de terrain (épidémiologie et clinique) et avec l’aide du laboratoire. Faire des prélèvements sur plusieurs chevaux au sein d’un foyer peut également aider au diagnostic.
Déclaration « syndromique » :
La gourme, qui faisait l’objet d’un sous réseau spécifique a été intégrée au sous réseau « SRA ». Dans un souci de facilités et de simplicité, il y aura donc désormais une seule fiche de déclaration pour les affections virales et pour la gourme. Le type de prélèvements est généralement identique : écouvillon nasopharyngé (on peut aussi utiliser le lavage nasal ou pus pour la gourme) et les analyses seront faites en PCR, qu’il s’agisse des identifications virales ou de la gourme. Il y aura un simple choix dichotomique à la rédaction de la fiche, même si, dans les rares cas qui sont équivoques les 2 recherches (virales et bactériennes) pourront être demandées. Rappelons que les prélèvements pour la gourme, contrairement aux prélèvements pour la virologie, ne doivent pas être trop précoces.
Retour sur le foyer de grippe « Grosbois 2009 »
Historique
Cet épisode de grippe équine a débuté le 12/02/2009 avec le prélèvement sur le centre de Grosbois d’un Trotteur Français présentant hyperthermie (39,7°C), toux et jetage muco-purulent. Selon les informations rapportées par le vétérinaire sentinelle du RESPE, d’autres chevaux présentaient des symptômes similaires depuis quelques jours dans la même cour.
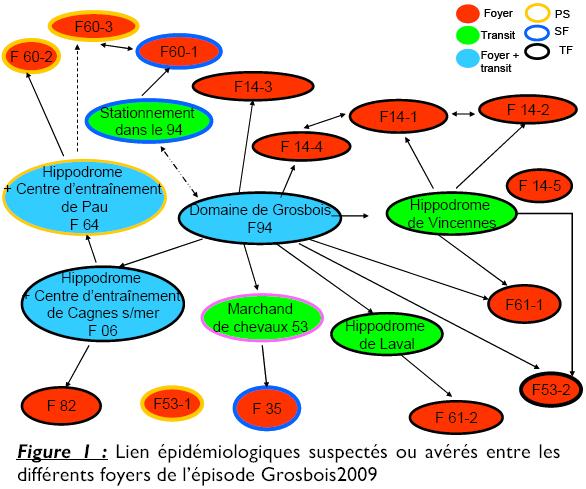
Le 20 février, les premiers cas de grippe sont identifiés en Normandie et le 25 février, des cas sont recensés sur l’hippodrome de Cagnes-sur-mer. Mi-mars, un foyer est répertorié dans le Tarn et Garonne, toujours chez des trotteurs. Début avril, des cas sont à nouveau identifiés en région parisienne mais cette fois autour de Chantilly, chez des chevaux de sport et des Purs sangs. Les derniers cas positifs rattachables à ce foyer Grosbois 2009 ont été identifiés fin juin en Ille-et-Vilaine. Cet épisode aura donc duré au moins cinq mois.
Intérêt de l’épidémiologie moléculaire
La comparaison des séquences de souches obtenues dans différents foyers permet aussi de confirmer ou infirmer des suspicions de liens épidémiologiques entre les foyers (Figure 1). Ainsi, la comparaison des séquences obtenues sur les souches grippales identifiées à Grosbois, Cagnes-sur-mer et dans le Tarn-et- Garonne a permis de confirmer le lien épidémiologique suspecté entre ces différents foyers. La même méthodologie a permis de rattacher les foyers de Chantilly à ceux de Grosbois et de Pau.
La souche française ayant circulée au cours de l’épisode Grosbois 2009 est une souche très proche du lignage OHIO 2003 qui domine ces dernières années : épisode japonais et australien par exemple.
 Parallèlement, la régression rapide de ces foyers peut être rapprochée du statut immunitaire des chevaux en France vis-à-vis de ce virus (virus Influenza équin), c’est-à-dire une population d’équidés correctement ou globalement assez régulièrement vaccinés mais aussi de la vigilance des vétérinaires sentinelles et des organismes socioprofessionnels du Réseau d’épidémiosurveillance en pathologie équine (RESPE) par lesquels l’information à très rapidement circulée.
Parallèlement, la régression rapide de ces foyers peut être rapprochée du statut immunitaire des chevaux en France vis-à-vis de ce virus (virus Influenza équin), c’est-à-dire une population d’équidés correctement ou globalement assez régulièrement vaccinés mais aussi de la vigilance des vétérinaires sentinelles et des organismes socioprofessionnels du Réseau d’épidémiosurveillance en pathologie équine (RESPE) par lesquels l’information à très rapidement circulée.A propos de ces tests, les suivis très documentés et le nombre important de tests effectués au sein ou en périphérie des foyers, ont permis de montrer que les chevaux pouvaient « héberger » des charges virales très faibles, détectées seulement par des outils plus performants comme la PCR et non par les tests rapides, très efficaces au pic d’excrétion du virus.
Aujourd’hui il est globalement reconnu que la vaccination des chevaux 2 fois par an reste le meilleur rempart à l’infection chez le cheval, notamment pour les sujets à risque ; les chevaux qui voyagent pour les épreuves internationales ou les chevaux qui croisent de nombreux autres chevaux au cours de l’année pour le rassemblement, les compétitions…
Remerciements :
A l’ensemble des vétérinaires sentinelles qui ont déclaré les cas et fait remonter des informations, et des détenteurs de chevaux qui ont accepté de participer à l’enquête.
Pour plus d’informations :
Veuillez consulter l’article : « Retour sur le foyer de grippe « Grosbois 2009 »
Herpes Virus Equins et PCR : Petite revue bibliographique
Dynon & coll. de l’Université de Melbourne ont publié en 2007 sur les différentes techniques de détection des virus en cas d’infection respiratoire aigue. Ils ont prélevé des écouvillons nasopharyngés et du sérum sur 20 chevaux présentant un syndrome fébrile respiratoire aigu qui était cliniquement compatible avec une étiologie virale. Les prélèvements ont été soumis à des isolements et cultures virologiques, à des tests par PCR et à des cinétiques sérologiques. Des virus furent isolés seulement sur 4 chevaux en culture (trois HVE4 et un ERBV2 : equine rhinitis B virus2). Par PCR un virus a été identifié chez 12 des 20 chevaux. Chez ces chevaux positifs 17 virus ont été identifiés : un cheval était positif en HEV4, HEV2, et HEV5, trois chevaux étaient doublement positifs (HEV4 et ERBV chez l’un, HEV2 et HEV5 chez les 2 autres) et huit chevaux étaient positifs sur un seul virus (2 en HEV4, 1 en HEV2, 6 en HEV5, et 6 en ERBV). Les trois chevaux sur lesquels HVE4 a été isolé dans les secrétions nasales étaient positifs en PCR mais un seul de ces chevaux a montré une séroconversion significative pour HEV4. Même s’il s’agit d’une étude prospective sur un nombre restreint de chevaux cette étude montre que l’isolement viral et la sérologie ont une sensibilité moindre que la PCR, que cette dernière technique permet l’identification d’un nombre important de virus sur des chevaux atteints d’affections respiratoires aigues et enfin l’importance d’autres virus comme l’ERBV (une étude canadienne avait déjà évalué du rhinovirus équin à 21%).
Pusterla a publié en 2009 avec son équipe de l’université de Davis en Californie deux intéressantes études sur la PCR et les HVE1. Une première étude publiée a consisté à suivre, au sein d’un foyer naturel de myéloencéphalopathie à HVE1, à partir d’écouvillons naso pharyngés et de prélèvements sanguins, et par différentes recherches par PCR, la cinétique des charges virales, les souches en jeu (neuropathogènes ou non) et le stade physiopathologique des virus (lytiques, quiescents, latents). La finesse de plus en plus grande des différentes techniques PCR pour détecter et suivre l’activité virale et les différentes souches au sein d’un foyer infectieux est remarquablement intéressante (résumé disponible en ligne).
La deuxième étude publiée en novembre 2009 a porté sur la comparaison de 4 méthodes différentes pour quantifier la charge virale en HVE1 dans les secrétions nasales de 4 chevaux infectés expérimentalement et de 30 chevaux présentant des signes cliniques compatibles avec une infection à HVE1. Sur les chevaux infectés expérimentalement des prélèvements ont été effectués quotidiennement pendant 13 jours. Sans entrer dans les détails techniques (voir résumé en ligne) il apparaît d’emblée que disposer d’une évaluation quantitative de la charge virale en HVE à partir des écouvillons naso-pharyngés est une avancée diagnostique très intéressante, qui permet d’apprécier le risque infectieux, le stade de l’infection et éventuellement la réponse aux traitements.
Éléments à retenir :
– Même si la culture et l’isolement viral reste une technique de référence, la PCR est devenue actuellement la technique diagnostique de choix en raison de sa haute sensibilité et de sa grande spécificité.
– La sensibilité et la valeur diagnostique du test par PCR au sein d’un foyer est augmentée en testant les chevaux en contact avec le cheval malade en particulier en cas d’hyperthermie. – Un test PCR positif sur les secrétions nasales indique que le cheval est excréteur de virus HVE au moment du test mais ne conclue pas sur le risque infectieux. La clinique et les conditions épidémiologiques doivent être prises en compte pour l’interprétation du test.
– La PCR conventionnelle (non quantitative) ne permet pas toujours de distinguer ni de quantifier une infection active d’une infection latente. Ce test n’est donc pas conseillé hors d’un contexte clinique évocateur d’une infection herpétique, ou d’examen médicaux complémentaires (cytologie respiratoire, hématologie….).
References :
– DYNON K, BLACK WD, FICORILLI N, HARTLEY CA, STUDDERT MJ. Detection of viruses in nasal swab samples from horses with acute, febrile, respiratory disease using virus isolation, polymerase chain reaction and serology. Aust Vet J. 2007 Jan Feb; 85(2): 46-50.
– PUSTERLA N, HUSSEY SB, MAPES S, LEUTENEGGER CM, MADIGAN JE, FERRARO GL, WILSON WD, LUNN DP. Comparison of four methods to quantify Equid herpesvirus 1 load by real-time polymerase chain reaction in nasal secretions of experimentally and naturally infected horses. J Vet Diagn Invest. 2009 Nov; 21(6): 836-40.
– PUSTERLA N, WILSON WD, MAPES S, FINNO C, ISBELL D, ARTHUR RM, FERRARO GL. Characterization of viral loads, strain and state of equine herpesvirus-1 using real-time PCR in horses following natural exposure at a racetrack in California. Vet J. 2009 Feb; 179(2): 230-9.
(1) Clinique vétérinaire de la Côte Fleurie
(2) Laboratoire Frank Duncombe
(2) Laboratoire Frank Duncombe

